腸管モデルを用いた食品成分の機能性評価と今後の展望
大澤 朗
神戸大学大学院農学研究科 食の安全・安心科学センター
教授・センター長
1. はじめに
我が国が近未来的に直面する最大の社会問題は、GDP(国内総生産)の上昇率を遥かに凌ぐペースで膨張する医療費の問題である。2025年には60兆円台になると推計される。この医療費の約1/3を、そして日本人の死因の6割も占めているのが「生活習慣病」と総称される高血圧、糖尿病、がん等を含む疾患群である。その名のごとく、我々の一人一人の生活習慣より起因する疾病なので、各々がそれを改善すれば予防・軽減・解消することは可能である。中でも食生活を改善することが非常に有効であることは、これまでの膨大な学問的な知見のみならず個々人の体験からも明らかである。
医療費の膨張を更に加速させるもう1つの社会問題が高齢化である。我が国は寿命年齢だけに注目すれば幸せな響きを持つ「長寿国」に格付けされているが、継続的な介護や医療に依存せずに自立した生活ができる生存期間、つまり「健康寿命」は寿命年齢よりも約10年も短くなる。即ち「要介護」の10年が我々大半の人生の最後の方で待ち構えている。この期間で特に深刻な疾患と思われるのは認知症である。認知症は本人のみならずその家族も、さらには介護・看護する施設の職員でさえもその状態の対応に難儀・苦慮する疾患で、昨今マスコミで報道されるように、大変悲惨な結末に終ってしまう場合もある。しかしこの認知症についても食事でその予防、その進行を遅らせる可能性が近年の科学研究(1), (2)で頻繁に提示されるようになった。
上述のごとく、我々が日々口にする食品には生活習慣病や認知症等を予防・軽減する機能を有するものがあり、それ故そのような食品(あるいは食品成分)を迅速に検索し、科学的エビデンスを供えた上で広く社会に提供してゆくことが火急の課題である。本稿ではこの課題に対して、筆者らのヒト腸管モデル着想の背景となった食品成分の腸内動態把握の重要性、それを踏まえた上で開発したヒト腸管モデルの概要、そしてそれを利用した機能性食品開発の展望を以下に解説することにする。
2. 食品成分の腸内動態
食品がヒトに喫食された後、その中に含まれる「機能性成分」と思しき成分が実際に体内で機能性を発揮するのか?を正しく評価するためには、当該成分が消化管から吸収された後の体内動態把握もさることながら、それに先立つ「内なる外」と言及される消化管内でどのような物理・化学的ストレスに曝され、変化してゆく有り様、即ち腸内動態を細部にわたり把握することが大切である。
胃・小腸部における食品成分の動態は下記の場合が考えられる。
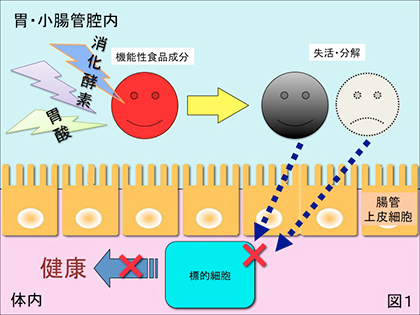
1) 胃酸、消化液、抗菌物質等の作用により機能性を失う場合(図1)。例えば健康食品に配合されている「酵素」等のタンパク質は殆んど胃や小腸の消化液によってアミノ酸まで分解されてしまうので、in vitro実験で確認された機能を全く発揮できない場合が多々ある。
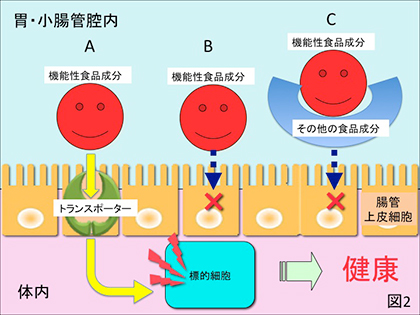
2) 喫食された成分が胃壁、小腸壁から吸収されて容易にヒト体内の標的細胞に達し、in vitro実験、動物実験で確認された額面通りの機能を発揮する場合。糖、アミノ酸、ペプチド、ビタミン等の分子量が1万以下の食品成分がこの場合に該当するが、これらを体内に吸収するためにはこれらを選択的に輸送するトランスポーターが腸管上皮細胞表面に装備されていることが必要である(図2-A)。
3) 比較的低分子なのに小腸壁から容易に吸収されない場合。例えば抗酸化機能を有するフラボノイドの1つケルセチンは非水溶性であること、また上述のようなトランスポーターがないことから腸管から吸収され難い(図2-B)。また同様に抗酸化機能を有する緑茶カテキンで没食子酸エステル型のエピガロカテキンガレート、エピカテキンガレートは食品中のタンパク質、デンプン等の高分子食品成分と結合し難吸収性の複合体を形成することからその生体利用性は非常に低い(図2-C)。
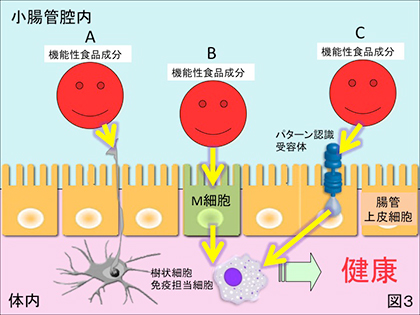
4) 上述とは逆に難消化性で腸管壁から体内へ吸収されることがなくても機能を発揮する場合。例えば、フコイダンやレンチナン等の高分子難消化性の多糖類や細菌菌体の免疫賦与性については、腸管上皮細胞の間隙から樹状突起を管腔内に延ばすとされる樹状細胞(図3-A)や小腸下部に点在するパイエル板に配備されたM細胞(図3-B)を介したメカニズムをもって専ら論じられてきたが、ヒトの腸管上皮細胞に接するだけでその細胞表層に具備されたパターン認識受容体を介した間接的な免疫賦与性(図3-C)が近年頻繁に報告されている。
胃・小腸部で消化・吸収されなかった食品成分は大腸に送られ、ここに棲息する腸内細菌叢に最大で30時間にわたり暴露され、最終的に便として外に排出される。大腸では小腸よりもさらに酸素分圧が減じ嫌気度が増すので偏性嫌気性細菌が最優勢となり、大腸内容物1g当たり1,000億?1兆個、500~1,500種の様々な代謝能を有する細菌で構成されている。しかしながら健常者の大腸表面は常時厚い粘液に覆われていることから、小腸の場合とは異なり、細菌群が直接大腸上皮細胞と接することはない(3)。
大腸部における食品成分の動態は下記の場合が考えられる。
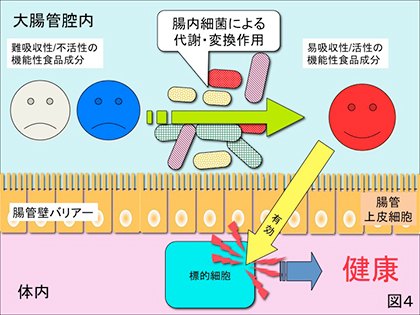
1) 上記と同様に小腸までは難消化・吸収、あるいは活性の低い成分であっても大腸内に到達するとそこに棲息する種々の腸内細菌によって分解、代謝、変換されて機能性を発揮する場合(図4)。代表的な例はオリゴ糖や難消化性食物繊維が挙げられ、これらは小腸までは難消化であり難吸収であるが大腸に入るとそこに棲息する一部細菌群に利用され腸内環境を良好にすることが知られている。
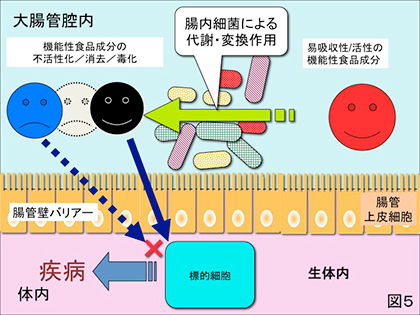
2) 通常は胃・小腸で吸収されて機能性を有するとされる食品成分が何らかの原因で大腸に入るとそこに棲息する腸内細菌によって分解されて機能性を失うばかりか、腸内細菌叢の変化やその代謝産物が宿主の健康を害する結果をもたらす場合(図5)。例えば、ダイエット飲料に使用されるサッカリンを始めスクラロース、アスパルテーム等の人工甘味料が大腸細菌叢のバランスを崩し(バクテロイデス門が優勢となり)、インスリン抵抗性、軽度の糖尿病症状をもたらすというこれもまた皮肉な所見が2014年イスラエルの研究グループによってNature誌に発表されている(4)。
3. 腸管モデルの構築
上記食品成分の腸内動態に鑑み、我々は主にTranswellR等を用いた免疫系腸管モデル(小腸モデル)と、ヒト腸内細菌叢モデルの2つのin vitro試験系を組み合わせた「腸管モデル」システム(Kobe University Human Intestinal Model [KUHIM])を構築し、既知機能性食品成分および新規の機能性食品成分のプロバイオティクス、プレバイオティクス、あるいはバイオジェニックスとしての機能性と安全性評価に取り組んでいる。本稿では小腸モデルの概要記載を割愛し、ヒト腸内細菌叢モデルの概要と利用例を紹介する。
ヒト腸内細菌叢モデル(Kobe University Human Intestinal Microbiota Model [KUHIM2])は単槽の連続嫌気培養装置によって個々人の腸内細菌叢環境を再現した培養モデルである。KUHIM2に投与された当該機能性食品素材の経時的な代謝変換、腸内細菌叢構成、代謝産物等を解析する。具体的には個々人の新鮮糞便を嫌気性菌用液体培地(例えばGAM培地)を基礎培地とした培養槽に少量添加し窒素/二酸化炭素混合ガスを培養槽に曝気させて嫌気としヒト大腸の環境を模した環境にして、24?30時間培養する。培養液を経時的に少量取り出して、定量PCR、次世代シークエンサーによるメタ16Sゲノム解析にて細菌叢の変化を門、属、種あるいは菌株レベルでモニタリングし、また培養中に産生される代謝産物の構成、投与された物質の分解・変換等のメタボロミクス解析を行う。国外にはヒト腸内細菌叢モデルとしてSHIME(5)(ベルギー・ゲント大学)およびTIM(6)(オランダ・TNO)といった複槽の連続嫌気培養装置を用いたものがあるが、いずれも外観と機構的にヒト消化管を疑似しているものの、培養に長時間を要すること、培養液中の細菌叢や産生されるSCFAs等の量や構成パターンは量的にも質的にも実際のヒト腸内を再現するには至っていない。これに対して、KUHIM2の培養系大腸モデルは下記の諸点においてヒトの腸内環境を模しているので、より正確な食品成分の機能性・安全性の評価が可能である(7)。
- 最終到達菌数:24~30時間培養後の培養液1 ml当たりの総細菌数が平均1011個台まで増殖している。
- 偏性嫌気性細菌優勢:上記培養液の菌叢は一般の健常人の糞便と同様、門レベルでFirmicutes とBacteroidetesが優勢である。
- 菌種レベルでの多様性:上記培養液から検知される細菌種の多様性がヒト糞便のそれ(約1,000~1,500種)とほぼ同等である。
- 難培養細菌の増殖:通常の平板培地上ではコロニーを形成せず単離することができない所謂「難培養」の細菌種も増殖している。
- 産生される短鎖脂肪酸の構成:本モデル24時間~30時間培養液は過去に報告された実際の健常人大腸内の短鎖脂肪酸の総量50~100 mMと構成比(酢酸:プロピオン酸:酪酸=3:1:1)を概ね模している。
上述の特徴に加え、小容量(100 ml)の培養槽を8器備えた培養装置(図6*:エイブル・バイオット社製、「Bio Jr.8」)を用いることで多検体・多項目の所謂「high throughputな」試験が一度に比較的短時間で行うことができる。従って1回の試験で、複数のヒト腸内細菌叢あるいは食品成分についてその動態を調べることができる。(*挿入写真:培養槽の側管のキャップを外し、培養器の嫌気状態を保ったまま外部からピペット等で培養液を随時採取可)

4. KUHIM2の利用例
KUHIM2を使った食品素材の機能性評価の例としては今の所下記の3点が挙げられるが、今後はさらに多岐の利用の仕方が提示される見込みである。
1) 難消化・難吸収性の小腸で消化吸収されずに大腸に行着く食品成分を添加した後のヒト腸内の経時的な細菌叢の構成の変化、代謝産物(主に有機酸等)および添加した成分の量・質的変化の予測。例えば、近年機能性食品として注目されている3種の難消化性食物繊維(難消化性デキストリン、α-シクロデキストリン、デキストラン)を極少量(0.2% wt/vol)を8個人のKUHIM2に供試して経時的な菌叢解析と代謝物解析を行った(8)。その結果、添加した食物繊維は腸内細菌叢の構成に殆んど影響を与なかったが、酢酸とプロピオン酸の産生を有意に上昇させた。
2) 通常胃、小腸で速やかに吸収され体内に入るとされる食品成分(ペプチド、アミノ酸、有機酸等)が何らかの事由により大腸内に流入した場合に起こりえる腸内細菌叢構成とその代謝産物、および添加した成分自体の量・質的変化シミュレーションによる新たな機能性あるいは危険性の予備検索をする。例えば、タウリンは生体組織中に高濃度に存在する遊離アミノ酸の一つであり、炎症性腸疾患に対して腸管での炎症を抑制する作用を持っている事が知られているが、タウリンはヒトの小腸で容易に吸収され、これを免れて大腸に到達してもそこに棲息する腸内細菌によって分解・代謝されてしまうので抗炎症効果は期待できないとされていた。しかしながらタウリンを8名分のKUHIM2に投入して、その動態を検証した結果、添加したタウリンがまったく消化されずに残存していたことからタウリンを何らかの手段にてヒト大腸内に届ける事ができれば潰瘍性大腸炎等の症状を軽減する可能性が示された(9) 。
3) 健常人の糞便サンプルからだけでなく、近年の研究で大腸細菌叢と因果関係があることが示唆されている疾病(大腸疾患、糖尿病、自閉症、アルツハイマー症等)の患者糞便サンプルからのモデルを構築し、病態と細菌叢およびその代謝産物に関連性があった場合はそれらの情報を病状診断に活用、あるいは病状を改善する機能性食品成分や治療薬の検索をする。例えば、潰瘍性大腸炎は、増悪と寛解を繰り返す慢性大腸炎で特徴付けられる原因不明の疾患だが、腸内細菌叢を含む腸内環境の異常が一因と認識されている。そこで筆者らは潰瘍性大腸炎患者11名と健常者13名のKUHIM2の30時間培養液の菌叢と短鎖脂肪酸の構成解析を行った(10)。その結果潰瘍性大腸炎の培養モデルでは、酪酸を産生するLachnospiraceae科に属する菌種が健常者に比べ有意に減少し、この減少は産生される酪酸濃度とも相関していたことからKUHIM2が腸内環境評価に有用であることが示された。
5. おわりに
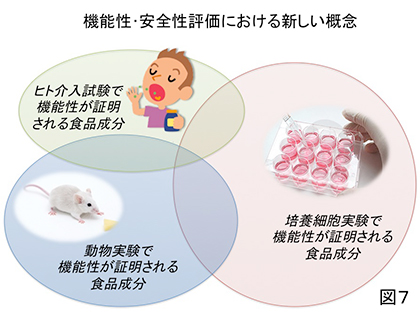
1990年代ぐらいから薬物・食品成分のヒト生体内での動きと変化を時間経過とともに把握するための学問分野、即ち薬物動態(Pharmacokinetics)の研究が世界的に盛んに行われるようになった。しかし、あくまでも血流や組織内に入った成分の動態を対象としたもので、経口投与された成分についても概ね「胃壁、小腸壁から容易に吸収される」という前提のもとで機能性・安全性が評価されている。しかしながら本稿で例示したようにヒトの腸管内に入った成分は他の食事成分、消化液、腸内細菌によって様々な作用、影響を受ける可能性がある。したがってこれからの食品成分の機能性の評価はヒト腸内における動態を把握した上で行われるべきものと考える。即ち、食品成分の中には培養細胞を用いたin vitro試験と動物実験での評価で「機能性あり」と評価されても後のヒト介入試験では全くその機能性が認められない場合、逆にヒトにのみ機能性が認められる場合も想定されるのである(図7)。前者のような「無益・無駄」(多くの実験動物の命も含む)と後者のような「取りこぼし」を少しでも減らすために、本稿で紹介した食品成分の腸内動態、即ち「食品成分腸内動態学(Gastrointestinal Food Kinetics)」とでも称される新たな研究分野に一人でも多くの大学・企業の研究者(特に若手の方々)が踏み込んで、KUHIMのようなツールを利用して、「死ぬまで元気でいたい!」というような普く人々の切実な願いに応える機能性食品が我が国の新たな「お家芸」的に開発・上市されることを期待してやまない。
謝辞
本稿で紹介したKUHIMは文部科学省科学技術振興調整費先端融合領域イノベーション創出拠点形成プログラム「バイオプロダクション次世代農工連携拠点」事業における研究活動より開発されたものです。
参考文献
(1)Pervin et al. 2018 Molecules 23(6): 1297
(2)Alkasir et al. 2017 Protein Cell 8(2): 90-102
(3)Johansson et al. 2011 PNAS 108 Suppl 1: 4659-4665
(4)Suez et al. 2014 Nature 515(7521): 181-186
(5)Molly et al. 1993 Appl Microbiol Biotechnol 39:254-258
(6)Minekuset al. 1995 Altern to Lab Anim 23:197-209
(7)Takagi et al. 2016 Plos One 11(8): e0160533
(8)Sasaki et al. 2018 Sci Rep 8: 435
(9)Sasaki et al. 2016 Plos One 12(7): e0180991
(10)Sasaki et al. in press Biotechnol J
大澤朗研究紹介ページ
(2019年2月)





