腸内細菌と食の相互作用から考える健康科学の最前線と創薬・機能性食品開発への展開
医薬基盤・健康・栄養研究所 ワクチン・アジュバント研究センター
センター長 國澤 純
我々が日々食事として摂取する成分の多くは我々の体の一部になることから、食事の量や内容は健康に直接影響を与えると考えられる。さらに食事の消化・吸収部位である腸管には千種類とも言われる腸内細菌が存在し、我々の身体機能に影響を与えている。さらに腸には体内の半分以上もの免疫細胞が存在するため、免疫臓器ともなっている。このお腹の免疫は、腸管局所のみならず腸管以外の臓器での免疫機能にも影響を与え、花粉症やアトピー性皮膚炎などとも関連しているということが分かってきた。さらに最近では、糖尿病などの生活習慣病においても腸を介した免疫の関与の可能性が示唆されている。これらの背景をもとに、現在、「食事」「腸内細菌」「腸管免疫」といったキーワードを中心に、腸(お腹)を介した健康維持・増進が社会的にも注目されている。私たちは現在、様々な分析技術を活用することで、食事や腸内細菌、免疫が形成する腸内環境と生体応答の実体を解明し、健康社会の実現に繋げようと研究を進めている。本マガジンでは食事や腸内細菌と健康との関係に関する基礎研究とそこから得られた知見を応用した創薬や機能性食品開発への展開について、我々の知見を中心に紹介する。
腸管免疫を介した恒常性維持システム
我々は、体表層を覆っている皮膚と内腔表面を覆っている粘膜組織を介して外界に接している。両組織には物理的・生物学的バリア機構が存在し、外部環境との共生関係をはかりながら、有害物質の侵入を阻止する役割を果たしている。さらに粘膜組織、特に腸管では、生命維持に不可欠な摂食という生理的行為を介して食事成分という異物に恒常的に晒されている。また腸管には千種類とも言われる腸内細菌も存在しており、これらも全て異物である。免疫の基本機能は「異物を認識し排除すること」であるが、腸管免疫は脾臓などの免疫システムとは異なり、食事成分や腸内細菌など生体にとって有益な異物に対しては、積極的に免疫学的な寛容(無視)を誘導することで、生体内への取り込み、利用、共存を可能にしている(1)。一方でこれら粘膜免疫システムの有する生体恒常性維持機構が破綻すると食物アレルギーや炎症性腸疾患といった腸管での免疫疾患の発症につながる(1)。
さらに近年の研究から、腸管免疫は腸管局所の免疫応答のみならず、呼吸器や皮膚など他の組織の免疫機能にも影響を与え、花粉症やアトピー性皮膚炎などとも関わることが示唆されている。さらには糖尿病などこれまで免疫とは関係のないと思われていた疾患も免疫が鍵となっており、そこでも腸管免疫が重要な役割を担っていることが判明してきた。これらのことから、腸、特に免疫を健常に保つことが体全体の健康につながると期待されている。
多くの免疫システムは、サイトカインなどの生体内因子により制御されている。さらに腸管免疫システムは、生体内因子だけではなく、食事由来成分や腸内細菌など腸内環境因子の影響を受けることが分かってきている。以降では、油を例に食事と腸内細菌の相互作用と健康について、最近の知見を交えて紹介したい。
食用油を介した免疫制御
食事由来成分は生体の一部として機能することから様々な健康状態に影響すると言われているが、その中でも特に油(脂質)は生体に影響を与える重要な分子である。我々が食事として日常的に摂取する植物油には多種類の長鎖脂肪酸が含まれるが、中でもω3、ω6として知られる脂肪酸は、ヒトを始めとするほ乳類の体内では合成できない必須脂肪酸であるため、食事の影響を強く受ける。古くから免疫や疾患との関連も示唆されており、例えば炎症性疾患に対しω6は促進、ω3は抑制に働くと言われている。
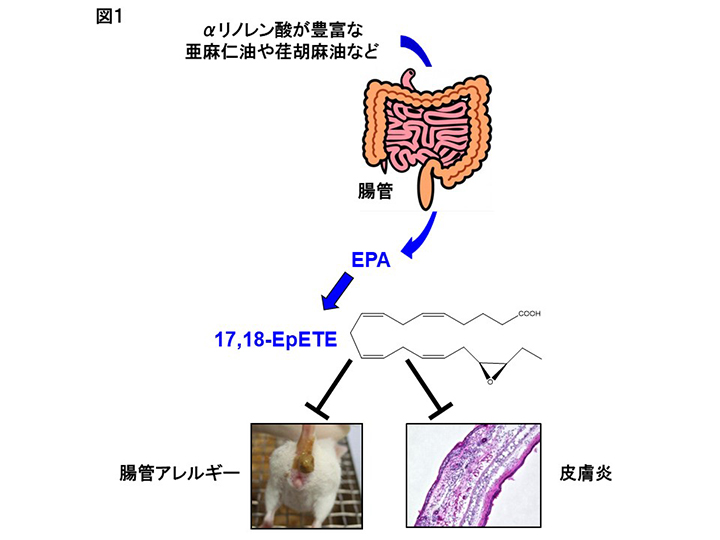
著者らは実際に食用油から摂取した脂質が、腸管組織の脂質組成に影響するのか検証するためにマウスを用いた解析を行った。通常マウスの飼育に用いられる餌にはサラダ油などにも使われている大豆油が用いられている。大豆油の構成脂質を見てみると、ω6脂肪酸のリノール酸を約50%、ω3脂肪酸のαリノレン酸を5%程度含んでいる。一方、近年健康に良いと注目されている亜麻仁油や荏胡麻油には、αリノレン酸が約60%と多く含まれている。通常餌と同様の割合である4%の各油を含む餌で飼育したマウスの腸管組織を解析したところ、大豆油餌で飼育したマウスの腸管ではリノール酸が、亜麻仁油餌で飼育したマウスの腸管にはαリノレン酸が、特に免疫細胞が多く存在する粘膜固有層に集積していることが判明した(2)。また、食用油由来の脂肪酸は体内に吸収された後、リノール酸はアラキドン酸へ、αリノレン酸はエイコサペンタエン酸(EPA)へと代謝される。大豆油や亜麻仁油で飼育したマウスにおいては、それぞれアラキドン酸やEPAも増加していたことから、食用油に含まれている脂肪酸が直接腸管の脂肪酸組成に影響するだけではなく、そこから代謝・産生される代謝物も食用油中の脂質組成の影響を受けることが判明した(2)。
古くからω3脂肪酸は抗アレルギー・炎症活性を始めとする健康に良い効果があることが知られている。そこで大豆油もしくは亜麻仁油で飼育したマウスに卵アレルギーモデルを適用したところ、大豆油で飼育したマウスではアレルギー性の下痢が観察されたのに対し、亜麻仁油で飼育したマウスではその発症が抑制された(2)。本実験においては油の量は4%と通常の餌と同レベルに統一していたことから、油の量ではなく脂質組成という油の中身が腸管でのアレルギー反応に影響を与えたことが分かる。
上述のようにEPAに代表されるω3脂肪酸は体に良い効果があることが知られている。近年、質量分析によるメタボローム解析が発達したこともあり、EPAからさらに代謝されて産生される代謝物により強い生体調節機能があることが分かってきた。著者らも亜麻仁油によるアレルギー抑制メカニズムを検討する目的で、亜麻仁油で飼育したマウスの腸管組織から脂質を回収し、メタボローム解析を行った。その結果、EPAから代謝・産生される17,18-エポキシエイコサテトラエン酸(17,18-EpETE)が亜麻仁油群で顕著に増加していることが明らかになった(2)。さらに大豆油で飼育したマウスに化学合成した17,18-EpETEを投与したところ、亜麻仁油餌で飼育したマウスと同様、卵アレルギーの発症抑制が認められた(2)。これら一連の結果から、亜麻仁油に含まれるαリノレン酸が腸管に取り込まれた後、EPAと変換され、さらにEPAの一部が17,18-EpTEに変換されることで腸管でのアレルギー反応が抑制されたと考えられる(図1)。さらに著者らは最近、17,18-EpETEが接触皮膚炎(かぶれ)のモデルにおいても、好中球に発現するGPR40に直接作用し、炎症部位への遊走を阻害することで、皮膚炎を抑制することをマウスとカニクイザルを用いた実験から明らかにした(図1)(2)。
脂質代謝の個人差と免疫応答
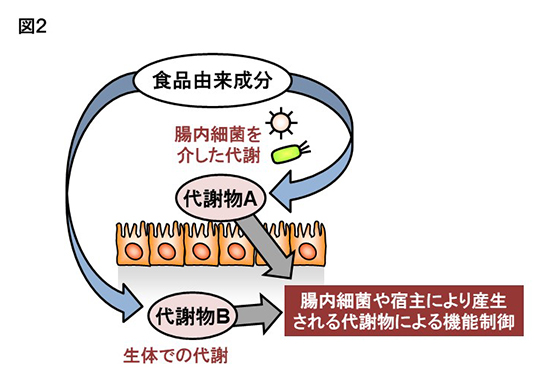
上記の結果から、EPAから代謝・産生される17,18-EpETEが腸管や皮膚のアレルギー・炎症反応の抑制に有効であることが判明した。現在、著者らはEPAから17,18-EpETEの変換に関わる酵素がシトクロムP450 (CYP)であることに着目している。CYPには基質の異なる多くのサブタイプがあり、また遺伝子多型も存在する。すなわちCYPを介した油の代謝には大きな個人差があると予想される。これらを考えると、同じように亜麻仁油もしくはEPAを摂取した場合にも、得られる効果は個人によって異なると予想される。つまり良いタイプのCYPを持つ場合は、亜麻仁油やEPAを摂取した際に17,18-EpETEなどの効果の強い代謝物が産生されるのに対し、別のタイプのCYPを持つ方は効果の弱いもしくは無い代謝物が産生されるため、亜麻仁油やEPAを多く摂取しても期待された効果が得られないことになる。すなわち摂取した油の有効性を決定する一つの要因は、個人が有する酵素のタイプや活性であると考えられる(図2)。
さらに最近の研究から、ヒトを含むほ乳類のみならず、発酵食品などに使用される微生物や腸内細菌も油の代謝に関わる酵素を持つことが分かってきた(3)。すなわちヒトが有効な酵素を有していない場合でも、腸内細菌や発酵食品を活用することで、有効な脂質を代謝・産生出来る可能性が期待される(図2)。
腸内細菌を介した脂質代謝と生体応答
上述のようにほ乳類の細胞だけでなく腸内細菌などの微生物も油の代謝を行っていることが分かってきた。特に、微生物の中にはほ乳類の細胞が持たない特殊な代謝酵素を持つものがあり、その機能が注目されている。例えば、ある種の乳酸菌はCLA-HY、CLA-DH、CLA-DCと呼ばれる酵素群を用い、リノール酸から10-hydroxy-cis-12-octadecenoic acid (HYA) → 10-oxo-cis-12-octadecenoic acid (KetoA) → 10-oxo-trans-11-octadecenoic acid (KetoC) といった代謝産物を産生する。最近の研究からその一つであるHYAについて、炎症性腸疾患における腸管バリア破綻の改善効果、アトピー性皮膚炎の抑制、腸管IgA抗体の産生増強など、生体保護機能が報告されている(3)。またKetoAは脂肪細胞の分化促進やアディポネクチン産生促進、肝細胞での中性脂肪減少などによる抗肥満作用などが知られている(3)。
腸内環境を対象としたコホート研究と健康科学への新展開
近年、腸内細菌が健康に関わる重要な因子として社会的にも注目されている。ヒトの腸内細菌はバクテロイデス型、プレボテラ型、ルミノコッカス型の3つのエンテロタイプに分類でき、それぞれたんぱく質や脂質をよく摂取するグループ(バクテロイデス型)、炭水化物、特に食物繊維をよく摂取するグループ(プレボテラ型)、中間の食生活グループ(ルミノコッカス型)と言われている。これらの腸内細菌のタイプは長年の食生活の影響を受けていることから、極端な食生活の変化などがない限り、多くは変化しないと考えられている。一方、上述のように腸内細菌は様々な食事成分の代謝に関わる酵素を持っており、食の有効性に影響を与えると考えられる。すなわちこれまで「何をどれだけ食べたか」で考えられていた食の効果が、「どんな機能を持つ腸内細菌が存在し、その際に何をどれだけ食べたか」ということまで考えることが出来る時代が来ようとしている。
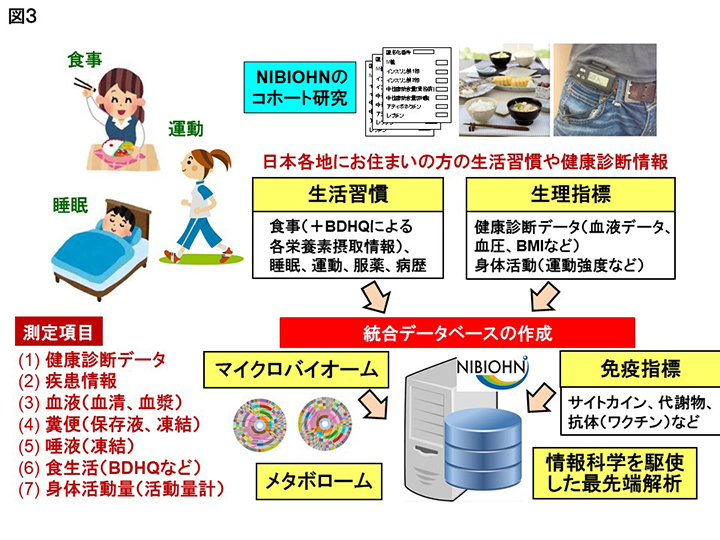
現在、著者らは、東京、大阪、山口、新潟など日本各地にお住まいの方の、腸内細菌と食事・栄養に着目したコホート研究を進めている。そこでは食事や健康診断、病歴の情報に加え、代謝物や生理活性物質なども測定し、それら全てを格納したデータベースならびにビッグデータ解析するためのプラットフォームを構築している(図3)。これらを活用することにより、腸内細菌や食習慣の違いによる腸内環境の変化や健康状態との関連、さらにそれを規定する代謝物や食事成分の同定などを進めている。これら一連の研究を通じ、将来的には保持している腸内細菌の構成や機能の情報と共に、腸内細菌叢に適した食材の摂取や効果的な調理方法などを提案出来るようになると期待される。すなわちこれらはPrecision nutritionや個別化栄養と言われる近未来型の健康科学に直結すると期待される。
引用情報
- 1. 臨床粘膜免疫学(清野宏編集)2011
- 2. Nagatake T and Kunisawa J, Emerging roles of metabolites of ω3 and ω6 essential fatty acids in the control of intestinal inflammation. Int Immunol. 2019 [Epub ahead of print]
- 3. Ogawa J, Kuniswa J, and Kimura I, The new era of postbiotics: Gut microbiome-derived lipid metabolites for health and wellness. Science (webinar)
https://www.sciencemag.org/custom-publishing/webinars/new-era-postbiotics-gut-microbiome- derived-lipid-metabolites-health-and?r3f_986
(2019年3月)





