食を豊かにする微生物機能 ~発酵醸造から食・腸内細菌・健康相関へ~
小川 順
京都大学大学院農学研究科応用生命科学専攻
発酵生理及び醸造学分野 教授
1.はじめに
発酵醸造食品に代表されるように、食品産業における微生物利用の歴史は古い。最近、食品成分の機能に対する意識が高まるにつれ、微生物機能をより積極的に機能性食品や栄養補助食品の生産ツールとして利用する動きが活発である。また、微生物機能の一翼を担う特定の酵素の具体的な機能を、機能性食品に応用する機運もある。さらには、微生物菌体そのものを機能性食品として活用する、いわゆるプロバイオティクスの開発も、腸内細菌が健康に及ばす影響が解明されるに伴って、盛んになってきている。加えて、腸内細菌が時として宿主にはない代謝活性を示し、食品成分を未知なる機能性化合物へと変換していることが解明されてきている。このような時流のなか、我々も、微生物機能を活用し新たな食品機能を創出する研究を行ってきた。本コラムでは、その中からいくつかの例をとりあげ、微生物機能開発の方法論がいかなるものか、また、その成果としてどのような食品機能が創造され供給可能となってきたか、さらには、今後の新たな食品機能の創出を牽引するであろう、食・腸内細菌機能・健康相関について紹介したい。
2.微生物機能を活用する新たな食品機能の創出
微生物から派生する食品機能は、①発酵あるいは微生物変換により生産される物質の活性に由来するもの、②微生物酵素の触媒能力に由来するもの、③微生物菌体そのもの、あるいはその代謝活性に由来するもの、に大別することが出来る。
上述の①の例として、微生物による機能性脂質生産に取り組んだ。動植物油脂には見られない脂肪酸組成を持つ微生物油脂(Single Cell Oil)の開発を行った。その結果、様々な機能性脂質を生産する微生物を探索により見いだした。例えば、乳幼児の脳の発育や、高齢者の脳機能維持に重要なアラキドン酸を高生産するMortierella属糸状菌の発見をもとに、多様な変異株の育種により、通常生体を構成するn-6(オメガ6)、n-3(オメガ3)系高度不飽和脂肪酸のみならず多様な高度不応和脂肪酸高含有油脂の供給を可能とした(図1)1)。
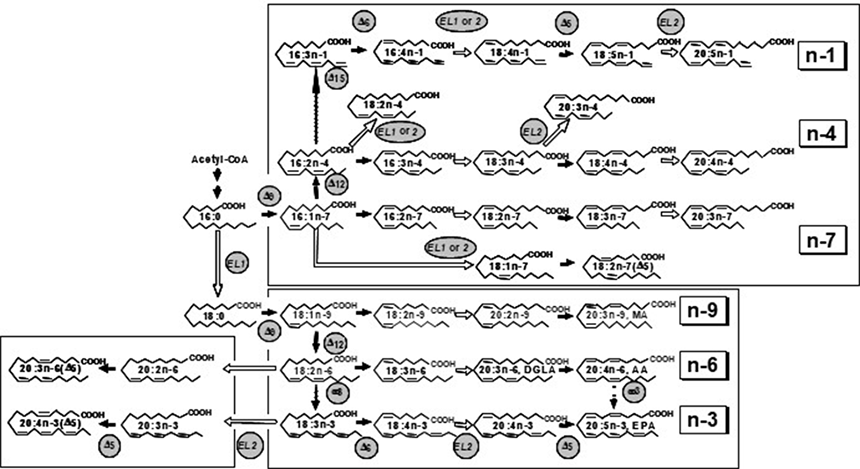
図1.M. alpina 1S-4およびその変異株におけるPUFAの生合成経路
図中のΔ9、ω3などは脂肪酸のそれぞれの番号の位置に二重結合を挿入する不飽和化酵素(DS)を、ELは鎖長延長酵素を表す。
AA; アラキドン酸, DGLA; ジホモ-γ-リノレン酸, EPA; エイコサペンタエン酸, MA; ミード酸
②の例として、微生物酵素による潜在的食品機能の向上に取り組んだ。具体的には、微生物酵素ラッカーゼの機能性食品酵素としての利用に取り組んだ。ラッカーゼはキノコが木を分解する際に放出する木質分解酵素である。ラッカーゼ高生産菌を探索し、Trametes属担子菌を見いだし、ラッカーゼの大量生産系を確立した。本ラッカーゼの機能開拓研究により、ある種の植物の香気成分(フェノール性化合物)のラッカーゼによる変換反応により、顕著な脱臭活性を発揮する化合物が生成することが観察され、口臭予防機能に優れたガムの配合成分としてラッカーゼが活用されている(図2)2)。
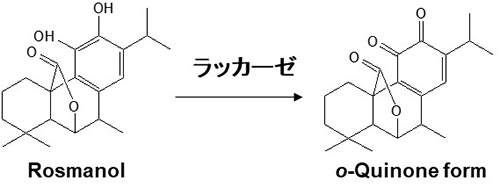
図2. ラッカーゼによるRosmanolの変換反応
③の例として、乳酸菌による高尿酸血症予防の可能性を検証した。食経験のある乳酸菌を対象に尿酸蓄積因子であるプリン体の代謝活性を解析し、高いプリンヌクレオシド分解活性を有するLactobacillus属乳酸菌を選抜した。本菌の経口投与は食餌性高尿酸血症モデルラットにおいて血清尿酸値の上昇抑制作用を示した3)。モデルラットでの検討のみならず、ヒトでの試験も試みられ、血中尿酸値が高値の者に対して有効性を示す結果が得られている。以上の結果により、乳酸菌を、高尿酸血症予防効果が期待できるプロバイオティクスとして利用できる可能性が示された(図3)。最近では、代謝活性を維持した状態で乳酸菌を腸まで届ける技術として、カカオ油脂などの食品油脂で乳酸菌をコーティングする技術も開発されている。本処理技術により、プリンヌクレオシド代謝活性が効率的に保持されることが示されている4)。
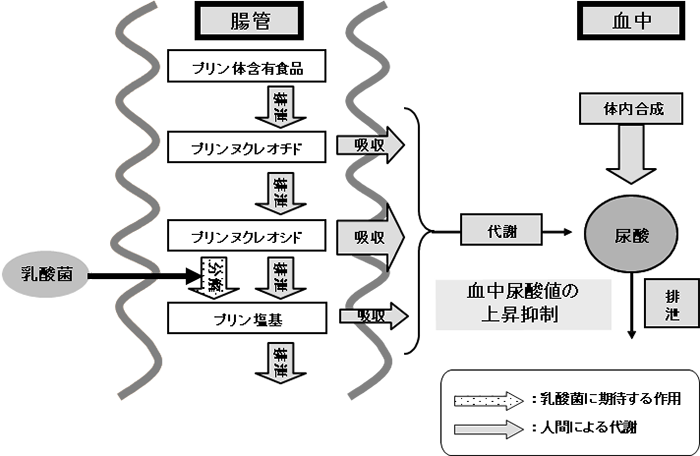
図3. 予想される乳酸菌の血中尿酸値上昇抑制機構
3.腸内細菌における食品成分代謝研究と健康増進への応用
食品成分は、ヒトの消化作用のみならず腸内細菌による代謝を受け、様々な化合物へと変換される。したがって、腸内細菌による食品等の機能性化合物の代謝を把握し、代謝産物が与える影響を評価することは、健康維持にとって重要である。ここでは、腸内細菌の一種であり食品産業にて広く利用される乳酸菌を中心に、食品等に由来する機能性化合物代謝の解明ならびに代謝産物の生理機能解析を、脂肪酸、アミノ酸、植物機能性成分の例を中心に紹介し、新たな機能性素材開発への展開を考察する。
3-1.食事脂質に由来する脂肪酸の腸内細菌代謝と応用
食事由来脂肪酸が腸内細菌により飽和化されること、代謝物として水酸化・オキソ・エノン脂肪酸などが生成し、宿主に移行していることを見いだした(図4)5)。これらの代謝物の生理機能を評価した結果、リノール酸由来の水酸化脂肪酸(10-ヒドロキシ-cis-12-オクタデセン酸:HYA)がマウス腸細胞ならびに骨髄系樹状細胞を用いた評価系において、炎症性サイトカインの産生を抑制することを見いだした。またHYAが、リポ多糖が誘発する骨髄系樹状細胞の成熟化を抑制し、抗酸化や解毒代謝を担う遺伝子群の転写を活性化することで細胞保護作用を示すことを見いだした6)。さらに、HYAがGPR40を起点とするシグナル伝達を介して、腸管上皮や歯肉上皮のバリア機能の低下を抑制すること見いだした7,8)。一方、α-リノレン酸由来の水酸化・オキソ脂肪酸が、単球の抗炎症性M2型マクロファージへの分化に寄与することを見出した。腸管粘膜免疫系に及ぼす影響を調べた結果、α-リノレン酸由来代謝物が腸管をTh2サイトカイン優位な環境に制御することが示唆された9)。このほかにも、水酸化・オキソ脂肪酸にPPAR、LXR、TRPV1を介した脂質代謝・エネルギー代謝制御機能を10-12)、エノン脂肪酸に抗酸化作用を13)、HYAに抗ヘリコバクター活性を見いだしている14)。これらの知見は、食事脂質の脂肪酸組成と腸内細菌の脂肪酸代謝活性の相互作用が、代謝物の生理機能を介して健康維持において重要な意味を持つことを示している15)。
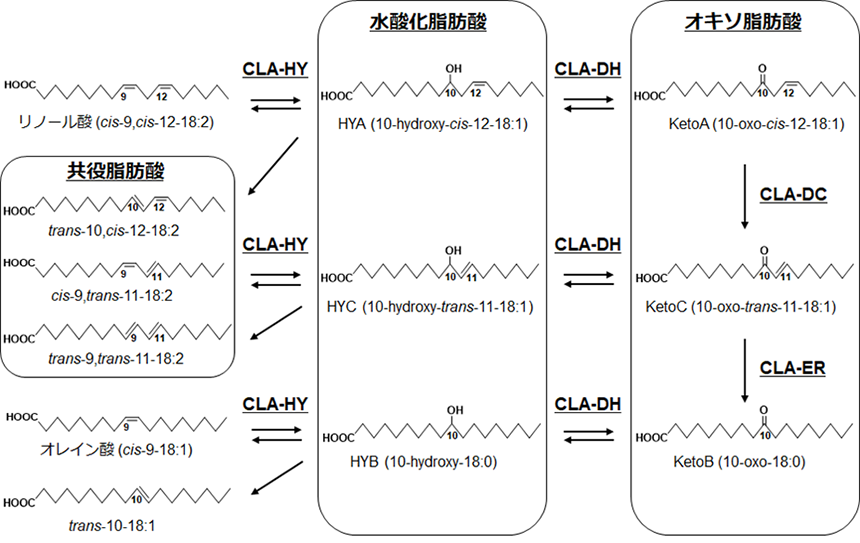
図4.腸内細菌の不飽和脂肪酸飽和化代謝
3-2.アミノ酸の腸内細菌によるラセミ化と応用
D-アミノ酸は天然には希少なアミノ酸であり、細菌のペプチドグリカンや微生物の産生する抗生物質等に含まれるにすぎないと考えられてきた。しかし近年、分析技術の発展により、ヒトを含む高等生物体内にも複数の遊離型D-アミノ酸が存在していることが明らかとなった。最近、遊離型D-アミノ酸が腸管内にも存在し、宿主のD-アミノ酸酸化酵素の発現への影響を介して腸内細菌叢を制御している可能性が見いだされてきている16)。例えば、D-アミノ酸酸化酵素はビブリオ属細菌の作るD-メチオニンに良く作用することで過酸化水素を発生し、ビブリオ属細菌に対して殺菌力を発揮する。また、栄養要求性が強い乳酸菌などの腸内共生菌は、D-アミノ酸が存在すると生育が向上するものもある。例えば、Pediococcus pentosaceus においてD-ロイシンの添加による対数増殖開始の遅延と定常期における菌体数の上昇を認めている17)。したがって、D-アミノ酸によるD-アミノ酸酸化酵素の発現向上が、結果的に腸管内のD-アミノ酸の分布と濃度を変化させ、腸内細菌叢の推移に影響を与えうると考えられる。
我々はこのD-アミノ酸の生理機能をプロバイオティクスを介して制御すべく、L-アミノ酸からD-アミノ酸へのラセミ化能を有する乳酸菌を探索した18)。その結果、複数のアミノ酸に対しラセミ化能を有する乳酸菌を、Lactobacillus属を主に多数見いだした。すべての菌において、反応がピリドキサールリン酸に依存的であり、アミノ酸ラセマーゼによる一段階のラセミ化反応である可能性が示唆された。これらのアミノ酸ラセミ化活性を有する乳酸菌を用い、食品由来のアミノ酸とのコンビネーションにより腸内細菌叢を制御しうる新たな応用の方向性が示された。
3-3.植物機能性成分の腸内細菌代謝と応用
1)グルコシノレート
ブロッコリー等のアブラナ科植物にはS-グリコシド結合型配糖体の一種であるグルコシノレートが含まれる。グルコシノレートはヒト体内において、ヒト自身の保有する酵素では分解されず、腸内細菌の働きにより分解されてイソチオシアネートに変換される。イソチオシアネートは抗がん、抗酸化、抗炎症など様々な生理機能を示すが、グルコシノレートは生理機能を示さないため、得られる生理機能は腸内菌叢のグルコシノレート分解活性に依存する。腸内細菌のグルコシノレート代謝に関与する酵素系は未解明であったことから、乳酸菌を対象に本酵素系の解析を試みた19)。グルコシノレートの一種であるシニグリンに対し高い分解活性を示したLactobacillus farciminis を用いて解析を行った結果、不明であった腸内細菌におけるグルコシノレート代謝が、PTS糖輸送体(phosphoenolpyruvate: sugar phosphotransferase system)、アリル-ホスホ-β-D-グルコシダーゼが関与する、リン酸化をともなう取り込みと細胞内でのリン酸化糖分解により構成されていることが明らかとなった(図5)。今後、本知見に着目したグルコシノレート分解菌の選抜と、そのプロバイオティクスとしての活用を通して、アブラナ科植物の生理機能を向上しうる新たなツールの開発が期待される。
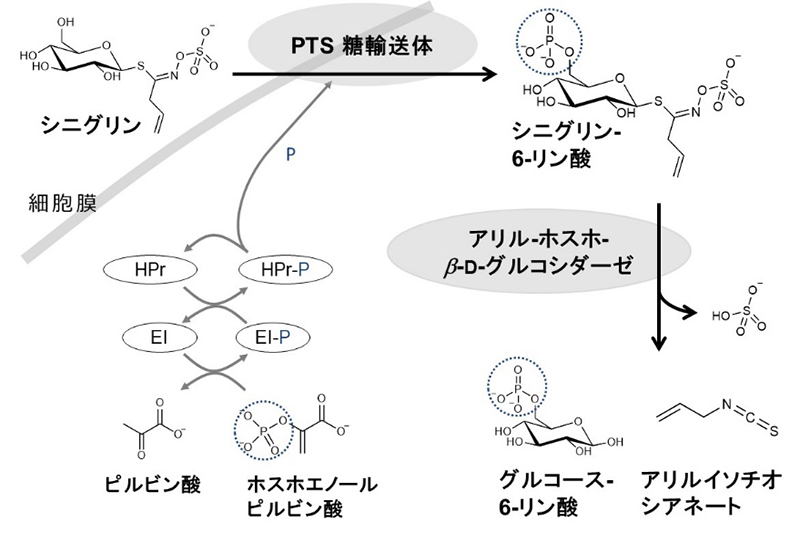
図5.Lactobacillus farciminis KB1089におけるシニグリン分解酵素系
2)フラボノイド配糖体
フラボノイドなどの植物の二次代謝産物には生理活性成分が多数存在し、それらの多くは配糖体として蓄積されている。バイカリン(baicalein; 7-O-β-D-glucuronide)は特定のシソ科植物で生産されるフラボノイドグルクロン酸配糖体であり、生薬成分としてよく知られている。その生理活性は、腸内細菌の糖質分解酵素β-グルクロニダーゼによる加水分解を受け発揮されるため、腸内細菌叢に依存する。一方で、腸内細菌のβ-グルクロニダーゼは体内の薬物代謝に密接に関係しており、グルクロン酸修飾により一度不活化された脂溶性生理活性物質を腸内でもう一度加水分解により活性化させ、体内に蓄積させてしまう腸肝循環の原因を担う酵素として知られている。よって、β-グルクロニダーゼ活性を有するプロバイオティクスを、そのままバイカリンの生理機能発現のために利用する際には腸肝循環も考慮する必要があると考えられる。我々は植物由来のフラボノイド配糖体に選択性を示すLactobacillus brevis subsp. coagulans由来のバイカリン変換酵素を同定し(図6)、腸内でのフラボノイド配糖体代謝酵素としての機能を解明した20)。本酵素(LcGUS30)は、体内ステロイドホルモンであるエストロン3-β-D-グルクロニドなどのヒト由来天然基質に対する親和性が低く、植物由来フラボノイド配糖体であるバイカリンを基質として好むことが示された。よって、L. brevis subsp. coagulansは腸肝循環に影響を与えず、経口摂取されたフラボノイドグルクロン酸配糖体に効率的に作用する、生薬の機能性向上に有用なプロバイオティクス候補である可能性が示された。
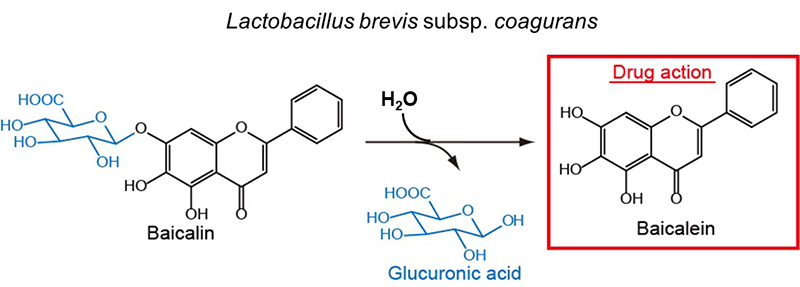
図6.Lactobacillus brevis subsp. coaguransによるバイカリンの分解
4.おわりに
本コラムが、微生物機能を食品機能開発に活用するにあたり、どの様な機能が研究対象となりうるのか、どの様な機能・機能性物質が潜在的に供給可能なのか、などの情報提供の機会となり、新たな食品機能創出の端緒となることを期待したい。
加えて、腸内細菌叢における食品成分の代謝ならびに代謝産物の生理機能解析は、腸内における複雑な共生関係を支える分子基盤の解明に役立つとともに、科学的根拠に基づいた食品成分由来の機能性分子の開発など、健康維持にとって重要な応用につながると考えられる。今後も、食品成分の腸内細菌代謝研究により得られた知見を基盤に、乳酸菌プロバイオティクスや機能性食品素材としての代謝物など、健康増進に資する新たなツールの開発が進むものと期待される。
(2019年8月)
文献
- 1) 小川 順ら:生物工学会誌、83、339-341 (2005)
- 2) 小川 順ら:日本醸造協会誌、99、832-849 (2004)
- 3) 小川 順ら:2005年度日本農芸化学会大会講演要旨集、244 (2005)
- 4) Y. Yonejima et al. Biocatal. Agric. Biotechnol., 4(4), 773-777 (2015)
- 5) S. Kishino et al. Proc. Natl. Acad. Sci. USA, 110(44), 17808-17813 (2013)
- 6) P. Bergamo et al. J. Funct. Foods, 2014: 11, 192-202 (2014)
- 7) J. Miyamoto J et al. J. Biol. Chem., 290(5), 2902-2918 (2015)
- 8) M. Yamada et al. Sci. Rep., 8, 9008 (2018)
- 9) R. Ohue-Kitano et al. FASEB J., 32(1), 304-318 (2018)
- 10) T. Goto T, et al. Biochem. Biophys. Res. Commun., 459(4), 597-603 (2015)
- 11) T. Nanthirudjanar et al. Lipids. 50(11), 1093-1102 (2015)
- 12) M. Kim et al. FASEB J. 31(11), 5036-5048 (2017)
- 13) H. Furumoto, et al. Toxicol. Appl. Pharmacol., 296, 1-9 (2016)
- 14) H. Matsui et al. Helicobacter, 22, e12430 (2017)
- 15) 岸野重信, 食品と開発, 54(2), 8-11 (2019)
- 16) J. Sasabe & M. Suzuki. Front. Microbiol., 9, 933 (2018)
- 17) 坂口貴之ら, 2016年度日本農芸化学会大会講演要旨, 2F209
- 18) 森川拓磨ら, 2018年度日本農芸化学会大会講演要旨, 2A10p09
- 19) 渡邊寛子ら, 2018年度日本農芸化学会大会講演要旨, 2A10p12
- 20) H. Sakurama et al. Appl. Microbiol. Biotechnol., 98(9), 4021-4032 (2014)





